专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18

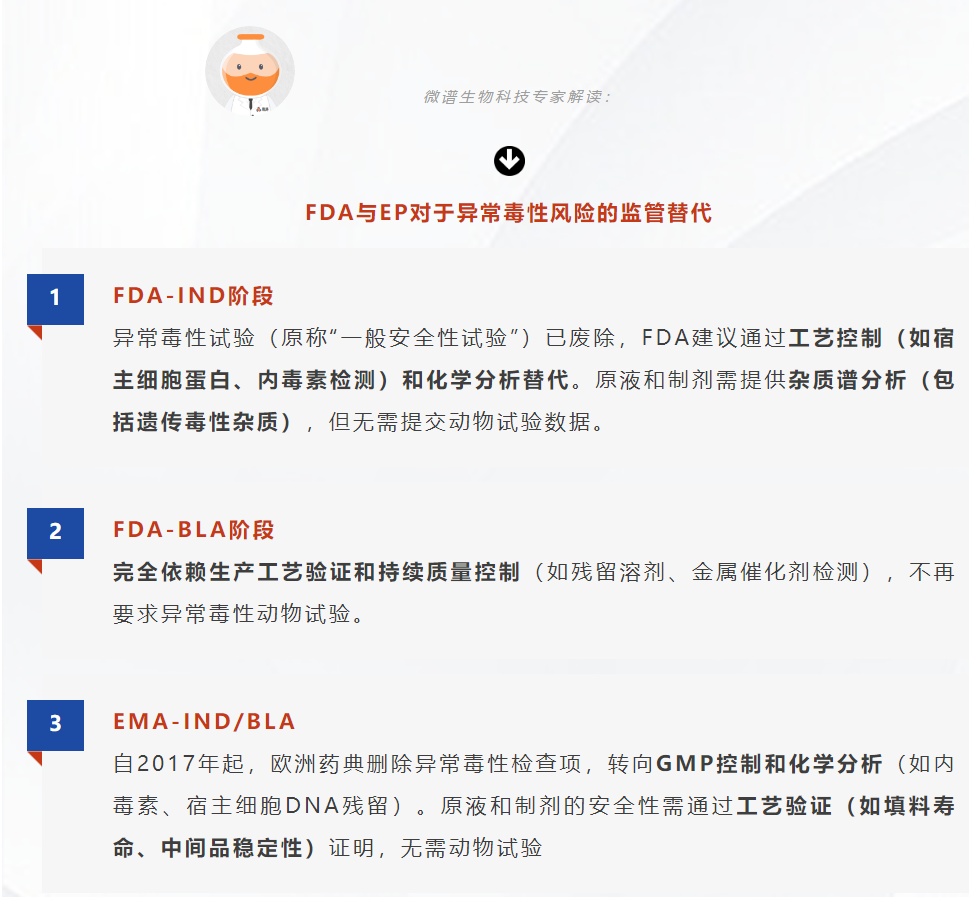
2025版药典为什么不取消异常毒性检查?根据风险评估情况可以做哪些调整?异常毒性检查可以用来提示哪些安全性风险?全球主要监管机构对异常毒性检查的规定是什么?对动物实验的要求有哪些关键变更?本期带来微谱生物科技专家对2025版药典解读系列的第5篇。

2025版《中国药典》三部凡例:
“品种正文设有异常毒性项目的,生产企业可结合风险评估结果与质量控制策略,不作为每批放行的必检项目,但仍需不定期检查。”
“当发生药学重大变更时必须检验足够批次,以确定变更后制品的安全性。”
“如某制品本身成分属性不适合进行异常毒性检查,在提供充分依据并经过评估的基础上,经批准可不做该项检查。”




2020版药典三部凡例生产及检定用动物:
应符合《生物制品生产及检定用实验动物质量控制》的相关要求,并规定日龄和体重范围。除另有规定外,检定用动物均应采用清洁级或清洁级以上的动物;小鼠应来自封闭群动物(Closed Colony Animals)或近交系动物(Inbred Strain Animals)。

▲ 图源丨2020版《中国药典》
2025版药典:
通则3601生物制品生产及检定用实验动物质量控制标准,关于实验动物微生物与寄生虫等级分类,通则删除了清洁级动物的定义,与《实验动物微生物与寄生虫等级及监测》(GB19422-2022)保持一致。25版药典修订后,则没有清洁级动物,变更为SPF级要求。

▲ 图源丨2025版《中国药典》
