专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18


根据国家药品监督管理局食品药品审核查验中心2025年1月发布的《清洁验证技术指南》及EMA《guideline setting health based exposure limits use risk identification manufacture different medicinal products shared facilities》(以下简称:药品共线生产指导原则),药品生产过程中的清洁验证工作需要依据基于健康的暴露限度(Health-Based Exposure Limits, HBEL)来确定残留物限度,这是清洁验证工作中最为关键的环节之一。
HBEL不仅关系到清洁验证的科学性和合理性,还能够有效降低药品生产过程中污染与交叉污染的风险。在EMA《关于在生产中实施基于风险的交叉污染预防和药品共线生产指导原则》问答文件Q10中指出,LD50不应作为确定药品HBEL的出发点。国内审评同样对LD50的使用持存疑态度。那么,值得讨论的是HBEL应该如何科学合理地建立呢?
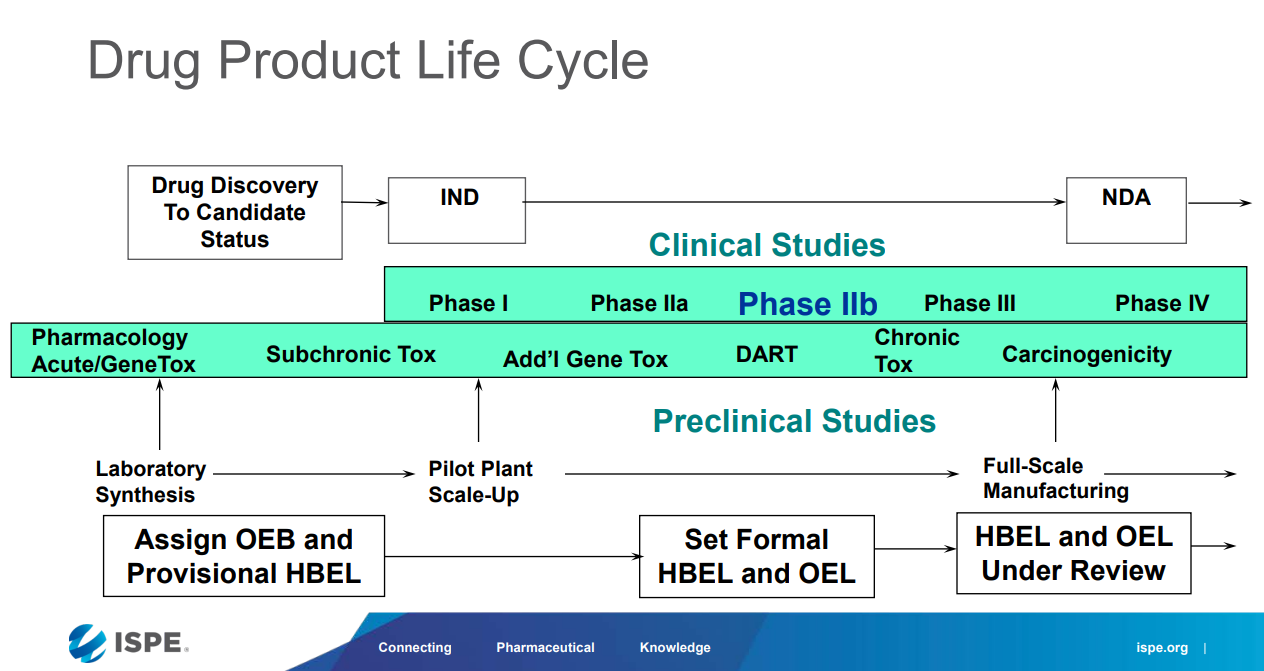
HBEL相较于传统方法(如 1/1000 最低日治疗剂量、10ppm 方法等)设定的限度,其可接受标准在评估清洁残留数据时在科学性方面更具优势。在计算HBEL时,除了考虑活性物质(原料药、生物药及中药)外,还应考虑其它毒性成分,如辅料、清洁剂、残留溶剂等的残留。HBEL通常为每日允许暴露量(Permitted Daily Exposure,PDE)或每日可接受暴露量(Acceptable Daily Exposure,ADE),代表人在终生暴露时长下的安全限度。
根据国内《清洁验证技术指南》及EMA/ISPE 《Case Study: Setting HBELs Throughout the Product Life Cycle》,PDE/ADE/OEL的计算公式为:

▲ 图源丨国家药品监督管理局食品药品审核查验中心:清洁验证技术指南
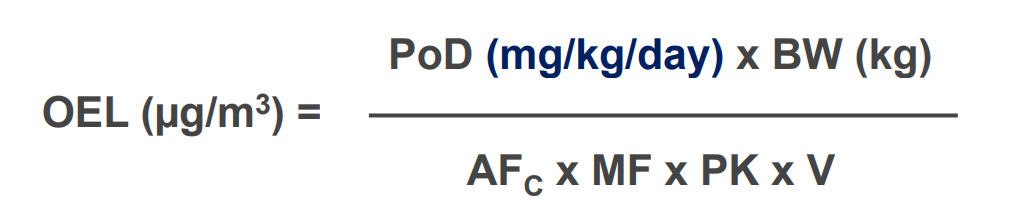
▲ 图源丨ISPE: Case Study: Setting HBELs Throughout the Product Life Cycle.
其推导过程包括:
1.危害识别的数据收集
用于危害识别的数据应包括:非临床药效学/药代动力学数据、重复剂量毒性研究、致癌性研究、体外和体内遗传毒性研究、生殖和发育毒性研究以及人体临床研究或临床使用数据,通过严格评估后确定其对推导HBEL的影响;
数据的收集应优先系统地选择国际主流药品监管机构的公开数据,如EMA、FDA、PMDA及NMPA,当权威机构数据有限时可选择其它权威的化学品毒性数据库或查阅相关文献。
2.识别关键效应
包括非临床毒性研究中出现的最敏感的不良反应及临床研究中的不良反应。
3.确定评估PoD(s)
在非临床研究中PoD应对应于NO(A)EL或LO(A)EL;在临床研究中PoD应对应于最高无效治疗剂量或临床治疗剂量。
4.不确定因子
参照ICH Q3C/Q3D系列PDE推导过程中不确定因子的取值,选取合适的不确定因子;对于缺少生殖发育毒性研究数据的情况时,应取额外的调整因子进行评估。
5.最终PDE的选择
当存在多个关键效应并推导得出多个PDE时,基于保守原则通常选取最低的PDE。
在评估具有遗传毒性的活性物质时,对于没有明显阈值的遗传毒性活性物质,认为任何水平的暴露都有风险。参照ICH M7对致突变性化合物可采用毒理学关注阈值TTC=1.5μg/天或采用线性外推法计算得出量化的十万分之一的患癌发生率(即终生风险水平);对于具有足够证据表明阈值相关机制的遗传毒性药物,可以通过使用PDE方法确定无明显遗传毒性风险的安全暴露水平。
微谱医药实验室拥有丰富的药品/化学品毒理评估项目经验,具备中国和美国毒理学家资质认证的技术团队。截至目前,我们已为上百余家客户提供了药物活性物质PDE评估报告,助力客户成功通过现场核查。微谱团队拥有近5000种非活性物质/材料添加剂毒性数据库及Case Ultra基毒预测评估软件, 致力于帮助客户解决药物研发申报中的相容性研究、杂质研究、香精小分子全类物质研究难题。
参考资料:
1. EMA 2014. Guideline on setting health based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities.
2. 国家药品监督管理局食品药品审核查验中心 2025. 清洁验证技术指南.
3. ICH Q3C (R9) 2024. IMPURITIES: GUIDELINE FOR RESIDUAL SOLVENTS.
4. ICH Q3D (R2) 2020. GUIDELINE FOR ELEMENTAL IMPURITIES.
5. ICH M7 (R2) 2023. Guideline on assessment and control of DNA reactive (mutagenic) impurities in pharmaceuticals to limit potential carcinogenic risk.
6. EMA/ISPE 《Case Study: Setting HBELs Throughout the Product Life Cycle》