专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18


一、转运体介导的DDI研究策略
转运体是一类表达于机体细胞膜上的特定蛋白质,药物转运体不仅在药物体内动态和药物间相互作用中起重要作用,而且也是创新药物设计的重要靶点。
▼转运体介导的DDI研究策略图
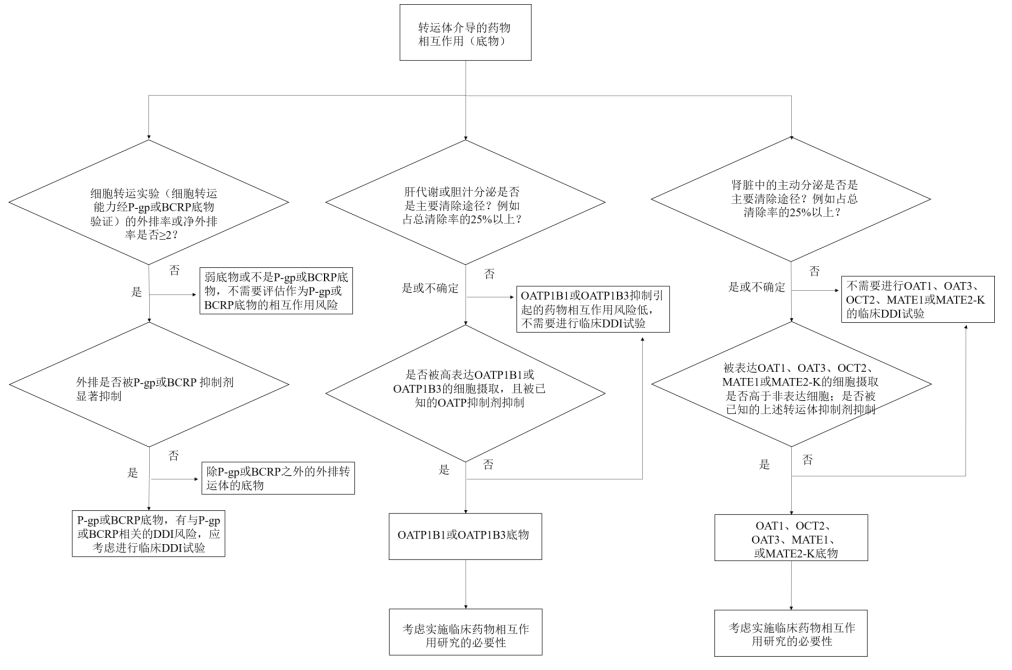
DDI的主要研究内容包括但不限于:
1
是否是促变药
在研药物是否可改变其它药物的药代动力学特征;
2
是否是受变药
其它药物是否可改变在研药物的药代动力学特征
3
DDI的程度
评估在研药物药代动力学参数的变化程度
4
DDI的临床意义
评估在研药物DDI的临床意义
5
DDI的预防措施
临床严重DDI的防控策略
二、临床DDI研究的设计与实施要点
ICHM12系统规范了临床DDI研究的类型、设计和实施要求,问答文件对样本量等关键参数提供了具体指导。
2.1 研究类型选择
独立与嵌套DDI研究
独立研究以DDI评价为主要目的;嵌套研究作为其他临床试验(如II/III期)的一部分,需预先规划和适当设计。
指针药物研究
使用强效指针抑制剂/诱导剂评估最大DDI潜力,结果可外推至相同机制的其他药物。
预期合并用药研究
评价与目标人群可能合用药物的DDI,更具临床针对性但其结果可能难以外推至其他药物。
鸡尾酒法
同时评价多种酶/转运体的抑制/诱导潜力。
生物标志物法
使用内源性底物(如CPI、4β-羟基胆固醇)评估DDI潜力。
2.2 关键设计考虑
样本量
通常每组12-20例,变异大或特定目的时需增加。应能可靠评估DDI程度和变异度。
剂量选择
促变药:临床最大剂量+最短间隔(评价最大DDI可能);
受变药:线性范围内任选剂量,或最可能观察到DDI的治疗剂量。
给药方案
抑制剂:多剂量给药(除非仅吸收环节作用);
诱导剂:7-14天预处理以达到最大诱导;
底物:若无非时间依赖性PK,可单次给药,若其具有时间依赖性药代动力学特征,则底物药物和促变药均应以多次给药的方式进行DDI评价。
研究人群
健康受试者(可外推时)或目标患者人群(安全性考虑时)
试验设计
优先选择交叉设计(减少变异);
若半衰期长,可采用平行设计(需更大样本量)。
采样与数据分析
采样需覆盖完整AUC(包括半衰期延长情况);
检测原形药+关键代谢产物(若机制复杂);
可稀疏采样促变药以确认暴露水平。
2.3 转运体DDI评价注意事项
2.3.1 作为转运体底物的药物
研究决策:是否进行临床DDI研究需综合评估药物的ADME特性、安全窗及合并用药可能性。核心原则是当转运体对药物的吸收、肝脏摄取或肾脏分泌起关键作用时,建议进行研究。
促变药选择:由于缺乏完美指针药物,通常选择临床常用的抑制剂或广谱抑制剂(如环孢素)来评估最大DDI风险。
研究策略:可采用“分步策略”——先用广谱抑制剂筛查,若结果为阳性,再用选择性抑制剂深入探究具体转运体的贡献。
其他工具:可利用转运体的基因多态性数据来辅助评估其临床重要性。
2.3.2 作为转运体抑制剂的药物
研究决策:通常基于与特定转运体底物合并使用的可能性及该底物的安全性来决定是否进行研究。
挑战与策略:
外推性差:因底物常受多转运体/酶影响,观察到的DDI可能是多因素结果。
除监测血浆原形药外,还可考虑检测代谢产物、药效学标志物或内源性生物标志物,以更全面了解对组织分布的影响。
2.3.3 作为转运体诱导剂的药物
主要机制:P-gp等转运体常与CYP3A共调节(如通过PXR),但其诱导程度通常弱于CYP3A。
研究策略:如果一个药物是中效或强效CYP3A诱导剂(使敏感底物AUC降低≥50%),则应考虑其诱导P-gp等转运体的潜力,并基于与转运体底物合用的可能性和安全窗等因素,决定是否进行专门的DDI研究。
特别注意:某些药物可能同时抑制CYP3A但诱导转运体(如P-gp),需综合判断其净效应。
2.4 结果解读标准
无效应界值
最佳基于暴露-效应关系,默认80-125%一般可接受。
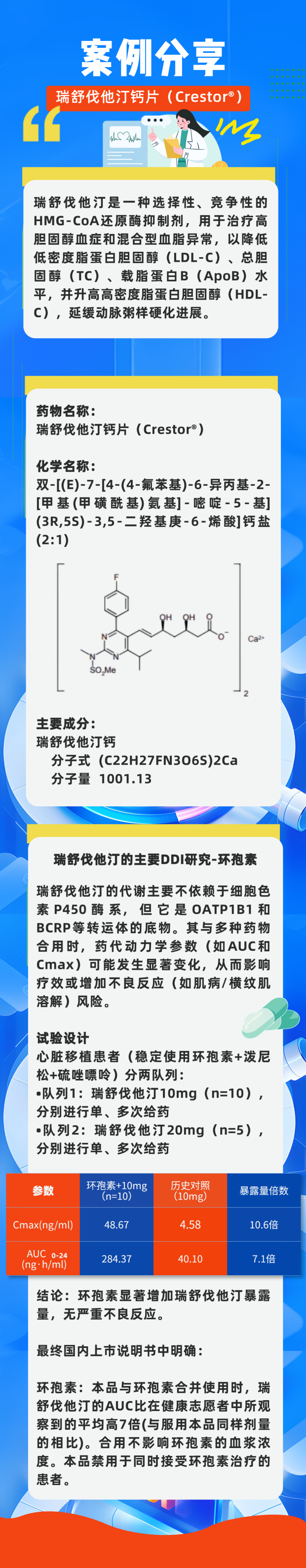
三、案例分享——以瑞舒伐他汀钙片(Crestor®)为例
更多详情 · 请联系
电话:021-3178-5055
邮箱:yiyao-marketing@weipugroup.com