专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18


2025年7月14日,国家药品监督管理局食品药品审核查验中心发布了关于公开征求《制药用水检查指南(征求意见稿)》意见的通知。确保制药用水质量符合最新指南要求,是相关企业实现高效运营的重要步骤。本期推文,微谱GMP验证服务专家将带来《制药用水检查指南(征求意见稿)》检测环节的最新要点解读。

1
纯化水(PW)
标准:符合《中国药典》纯化水项下的规定。
2
注射用水(WFI)
标准:符合《中国药典》注射用水项下的规定。
非蒸馏法:需提供等效蒸馏验证数据(≥3 个月并行比对)。
3
纯蒸汽
标准:冷凝水符合《中国药典》注射用水标准。

1
验证期
第二阶段:至少 2 周,每点每日全检,数据用于生产。
第三阶段:至少12个月(含第1和2阶段),涵盖不同季节,日常监测频率降低。
2
日常监测
最差条件位点:纳入年度回顾。
在线-离线数据一致性:确保在线监测与离线检测结果一致。

1
数据完整性
警戒/纠偏限:基于验证数据动态更新。
2
偏差管理
OOS/偏差:24 小时内启动调查,CAPA 闭环管理。

1
微生物、内毒素
可采用经验证的快速检测方法,但需与传统方法建立定量相关性,并保留全部原始数据

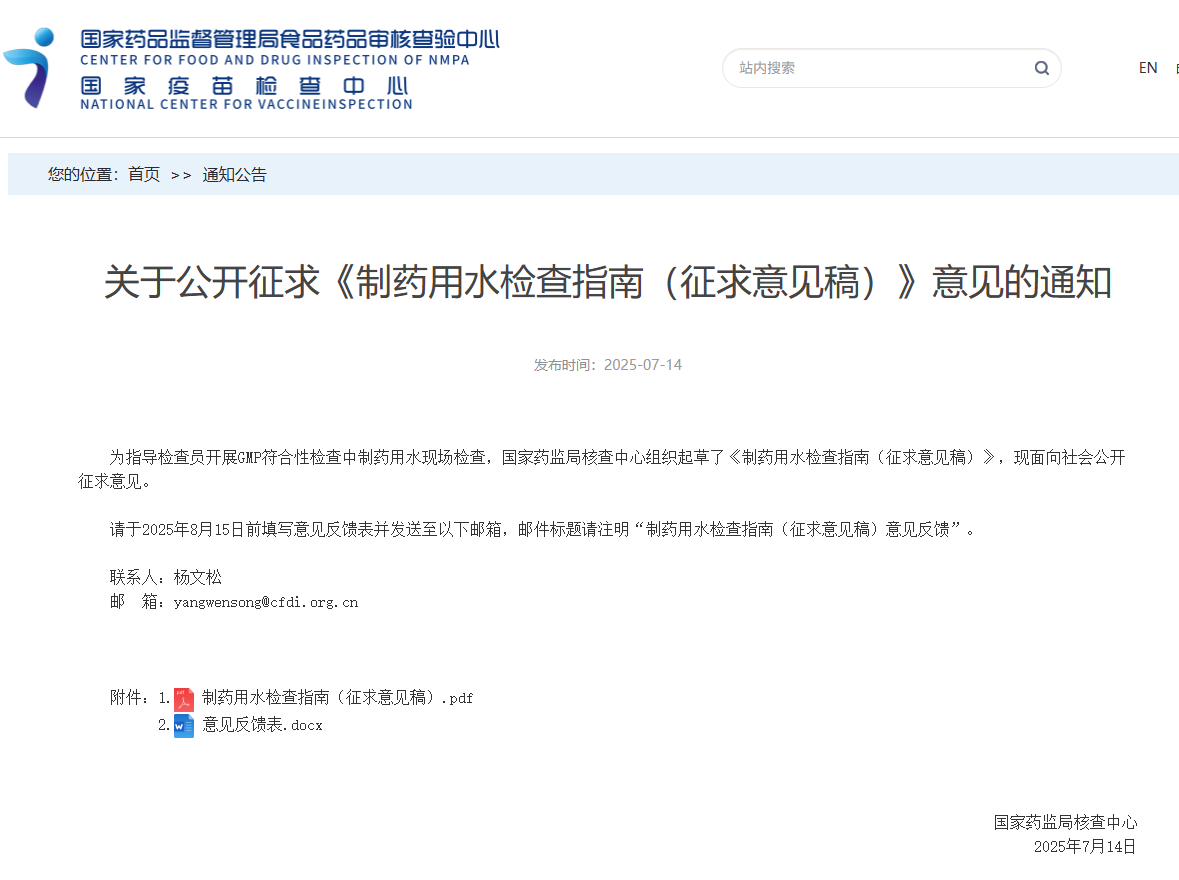
关于公开征求《制药用水检查指南(征求意见稿)》意见的通知
发布时间:2025-07-14
为指导检查员开展GMP符合性检查中制药用水现场检查,国家药监局核查中心组织起草了《制药用水检查指南(征求意见稿)》,现面向社会公开征求意见。
请于2025年8月15日前填写意见反馈表并发送至以下邮箱,邮件标题请注明“制药用水检查指南(征求意见稿)意见反馈”。
联系人:杨文松
邮 箱:yangwensong@cfdi.org.cn
国家药监局核查中心
2025年7月14日

关于我们
微谱于2014年正式涉足生物制品服务领域,立足于生物医药全产业链,依托创新型自主知识产权体系构建出成熟的生物制品质量研究平台、生物安全服务平台、动物实验服务平台、NGS合规检测平台、GMP验证服务平台、药品包材理化服务平台以及药械知识产权服务平台,致力于为国内外生物药企业提供合规、专业、一体化的生物制品质量与安全研究综合解决方案。
更多详情 · 请联系
邮箱:yiyao-marketing@weipugroup.com