专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18


4月28日,由药检汇举办的「药包材与药用辅料技术网络研讨会」在线开展,共吸引2717人次关注。正大天晴、齐鲁制药、先声药业、北京科兴、上药信谊、石药集团等知名企业参会。微谱生物医药毒理学研究专家王菲老师在研讨会上发表演讲 ——《相容性研究中毒理学风险评估应用》,引起广泛关注,线上反响热烈。
 (直播当日观看人次2717)
(直播当日观看人次2717)
相容性研究中毒理学风险评估的应用

王菲
微谱生物医药 毒理学研究专家
毕业于中国科学院上海药物研究所。长期专注药理及毒理学研究,深耕国内外市场药品包装材料及医疗器械相关毒理学风险评估领域,熟稔GB、ISO、FDA、ICH、REACH、ECETOC等一系列国内外毒理学风险评估标准,作为核心技术专家推动了诸多药品及医疗器械在国内外的获批上市,拥有EU市场、FDA、NMPA等多个监管部门的成功注册经历。
演讲回顾
此次演讲围绕三个主题展开:一是毒理学风险评估概念界定,二是相容性研究毒理学阈值概念及延展,三是相容性研究毒理评估方法简介。
相容性研究中为什么要做毒理学风险评估?
对于已知化合物,须通过一系列生物学实验对其在人体中可能存在的风险进行评估。
鉴于目前大多数常见物质的生物学实验数据库已近趋完善,可实现对化合物的风险评估,其检索评估的成本远低于生物学实验,因此毒理学风险评估已逐步代替生物学实验。一部分监管单位如FDA也建议结合化合物的毒理学数据来开展风险评估。
01
毒理学风险评估简介
毒理学风险评估是由毒理学(Toxicology)和风险评估(Risk Assessment)两部分组成的,毒理学主要研究化学品对生物体造成的不良反应;风险评估则包含危害识别、暴露评估和风险评估三个维度。
风险评估的首要工作是通过对危害的识别来判断化合物可能会产生哪些不良反应;其次须对化合物的暴露量进行分析;最后结合其危害和暴露量,判断是否有风险。值得注意的是,暴露不等于有风险,只有当暴露量超过安全限值,才可能存在风险。
危害识别 - 获取毒理学数据
毒理学数据来源:
权威机构文件:FDA,ICH ,U.S.EPA,Health Canada,Danish EPA,ATSDR,WHO / JECFA,EFSA,OECD 等
公开数据库:ECHA,HSDB 等
期刊研究
其他
危害识别 - 识别终点(POD)
Hazard
识别化合物毒性:全身毒性、基因毒性、致癌性、生殖发育毒性、神经毒性、刺激性、致敏性等
识别化合物毒性剂量:NOAEL - No observed adverse health effect;LOAEL - Lowest observed adverse health effect;BMDL - Benchmark dose modelling 等
安全阈值:通过应用NOAEL等数据,结合不确定因子,得到的安全阈值,表征该阈值下不存在安全风险。
安全阈值的不同名词:DNEL、AL、PDE、AI、MRL、RfD、ADI …
暴露评估
Exposure
依据产品信息进行暴露评估:接触途径、接触人群、接触时间。
确定暴露实际发生的程度。暴露水平通常是估计值或测量值。
风险评估
结合危害识别终点和暴露评估的信息,得到关于风险性质和程度的结论,并在需要时实施额外的风险管理措施。
Exposure>Hazard
Unacceptable
Exposure<Hazard
Acceptable
02
相容性研究毒理学阈值简介
药包材中常见的毒理学阈值
TTC 毒理学关注阈值 Threshold of Toxicological Concern
SCT 安全性阈值 Safety Concern Threshold
AET 分析评价阈值 Analytical Evaluation Threshold
QT 界定阈值 Qualification Threshold
PDE 人每日允许最大暴露量 Permitted Daily Exposure
AI 可接受摄入量 Acceptable Intake
王菲老师对TTC的分类及相应阈值、考虑基因毒性/非基因毒性的情况、ICH M7指导下TTC阈值在致突变杂质毒理评估中的应用、安全性阈值SCT及其应用、界定阈值QT以及分析评价阈值AET的计算等相关概念一一进行解析。
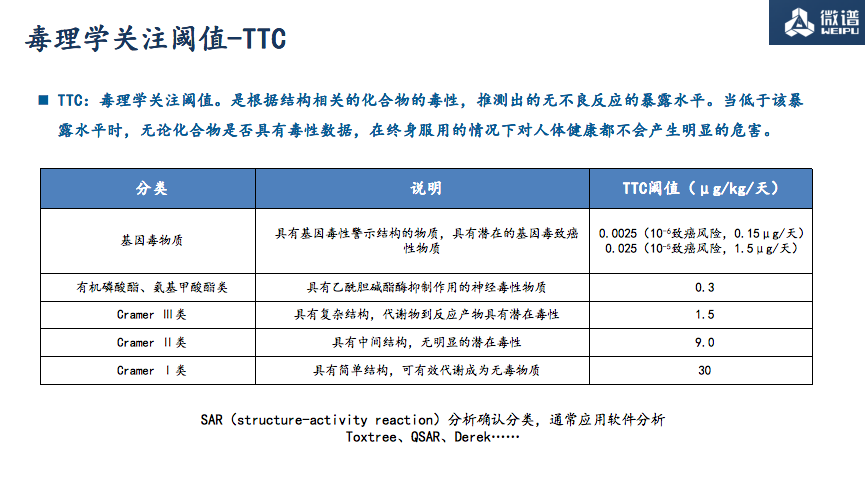 (TTC阈值描述)
(TTC阈值描述)
03
相容性研究毒理评估方法简介
毒理学评估流程
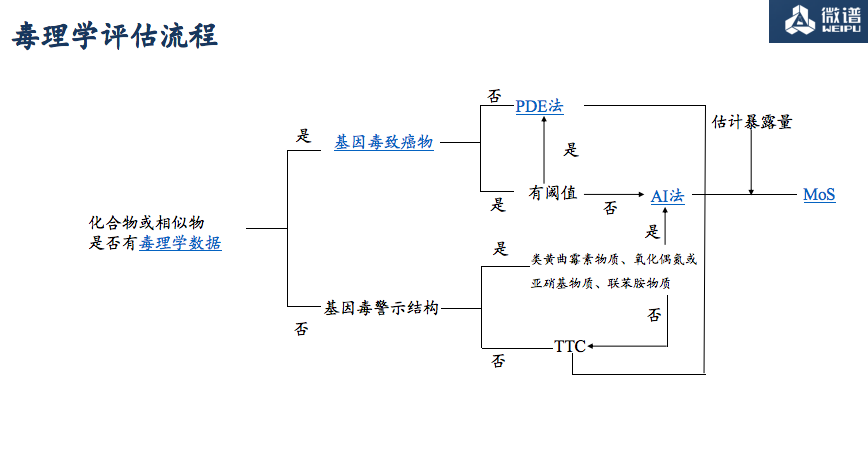
01 基因毒致癌物质的判断
试验数据
软件预测
专家判断
02 AI 值和 PDE 值推导
王菲老师分享了ICH M7原则指导下AI值推导的三种方法:「TD50 法」、「斜率因子SF法」、「其他已公布的法规限度参考」。
PDE值则是在ICH Q3C 及 ICH Q3D 指导原则下,根据公式进行推导:

↓
POD(Point of Departure),关键评估终点,通过毒理学数据库检索获得的人类或动物相关毒理学试验的数据,如NOAEL、LOAEL、政府或权威机构限值等。
F1~F6:不确定因子,对种内差异、种间差异、暴露时间、途径转换等的修正。
BW:人体体重,默认成人50kg,如产品适用其他人群需分别进行评估。
03 MoS 安全边界
MoS是辅助判断的工具,即一种物质的可耐受摄入量与患者每天接触该物质的比例(或浓度)之间的比值。
MoS = 安全阈值(如PDE、AI值)÷ 估计暴露量
当MoS<1.0时 需进一步进行安全性评价:
可提取物研究 进一步进行浸出物研究。
浸出物研究 更换材料、进行风险与获益分析,确保风险可控。如存在基因毒警示结构,建议进行生物学Ames试验。
04
小结
1. 毒理学阈值的应用
TTC值
当缺少化合物相关毒理学数据时,根据构效关系归类的阈值;
SCT值
应用基因毒警示结构化合物TTC阈值,结合不同给药途径及风险,得到相应的SCT值,PQRI推荐风险高的制剂类型如OINDP 为0.15μg/天,风险较低制剂类型如PDP为1.5μg/天;
QT值
在该阈值以下,对于化合物的非致癌性作用的担忧可忽略不计,通常为5μg/天;
AET
可提取物研究中使用SCT值结合给药剂量计算的阈值,超过AET的可提取物需进行毒理学评估。
2. 可提取物、浸出物研究中的毒理学评估方法
AI法
线性推导方法,用于对基因毒致癌物质的评估;
PDE法
非线性推导法,用于对非基因毒致癌物质的评估。
3.可提取物、浸出物安全性评价
① 可提取物MoS <1.0时,需要关注其毒理学风险,进一步进行浸出物研究;对于MoS ≥1.0的可提取物,可以结合产品材料本身或加工过程中的添加剂、原材料信息,根据可提取物在相关法规中的受关注度,选取合适的可提取物作为目标物进行进一步的浸出物研究。
② 浸出物MoS<1.0,需进行材料、工艺风险控制和/或生物学评价试验。