专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18


药品标准是药品质量和安全的标尺,药典是国家药品标准体系的核心。日前,第十二届药典委员会执行委员会全体会议在京召开,审议通过2025年版《中国药典(草案)》。行业翘首以待的新版药典终于走进公布倒计时。
虽然新版药典尚未正式公布,但我们已能从历次修订公示中初窥其貌。它会有什么新变化?哪些内容需要行业重点关注?聚焦生物制品领域,本期的专家解读将为您带来2025版药典《生物制品生产用动物细胞基质制备及质量控制》微谱系列解读的首篇文章。
—— 1. 按照工艺与来源对细胞基质进行分类的编写逻辑
对比2020版,2025版药典《生物制品生产用动物细胞基质制备及质量控制》更强调按照工艺与来源对细胞基质进行分类的编写逻辑。
第一部分:按照细胞基质类型动物或人源的连续传代细胞系(如CHO、HEK293、VERO、HELA等)对生产用细胞基质进行总的要求;
第二部分:按照二倍体细胞株(如WI38、MRC-5、2BS、KMB17或者MSC、IPSC、NK、TIL、PBMC等)对新建人二倍体细胞株进行要求;
第三部分:按照原代细胞(如MDCK等病毒性疫苗、药学筛选用途原代细胞)展开对原代细胞的要求。
需要注意的是,此制备与质量控制要求不包括细胞治疗产品制剂,但可作为参考。

图1:2025版与2020版药典修订对比
图源:国家药典委员会官网
—— 2.根据实际工艺开发历程对全生产周期进行规定
历经三轮修订与公示,2025版药典《生物制品生产用动物细胞基质制备及质量控制》的最终公示草案中对生产用细胞基质总的要求,包括从细胞系/细胞株历史来源与培养资料、细胞培养操作要求直至建立细胞系与冻存、细胞库建库与管理、细胞检定要求到生产用细胞的培养要求,应用逻辑更加清晰明确。

图2:2025版药典细胞库检定要求历经三轮修订与公示
图源:国家药典委员会官网
—— 3.在全生产周期的管理中,根据风险评估制定检定策略
对细胞类型与培养过程进行风险评估,如是否属于生产对照细胞、新建细胞系、稳转细胞株、是否引入外源病毒因子等,制定合适的检测方案,其中包括:细胞鉴别试验、细菌真菌检查、分枝杆菌检查、支原体/螺原体检查、细胞内外源病毒因子检查(包括:体外培养法检测、动物体内接种法检测、逆转录病毒检测、种属特异性病毒检测、牛源病毒检测、猪源病毒检测、其他特定病毒检测、分子生物学方法NAT与NGS)、成瘤性检查、致瘤性检查、稳定性等。
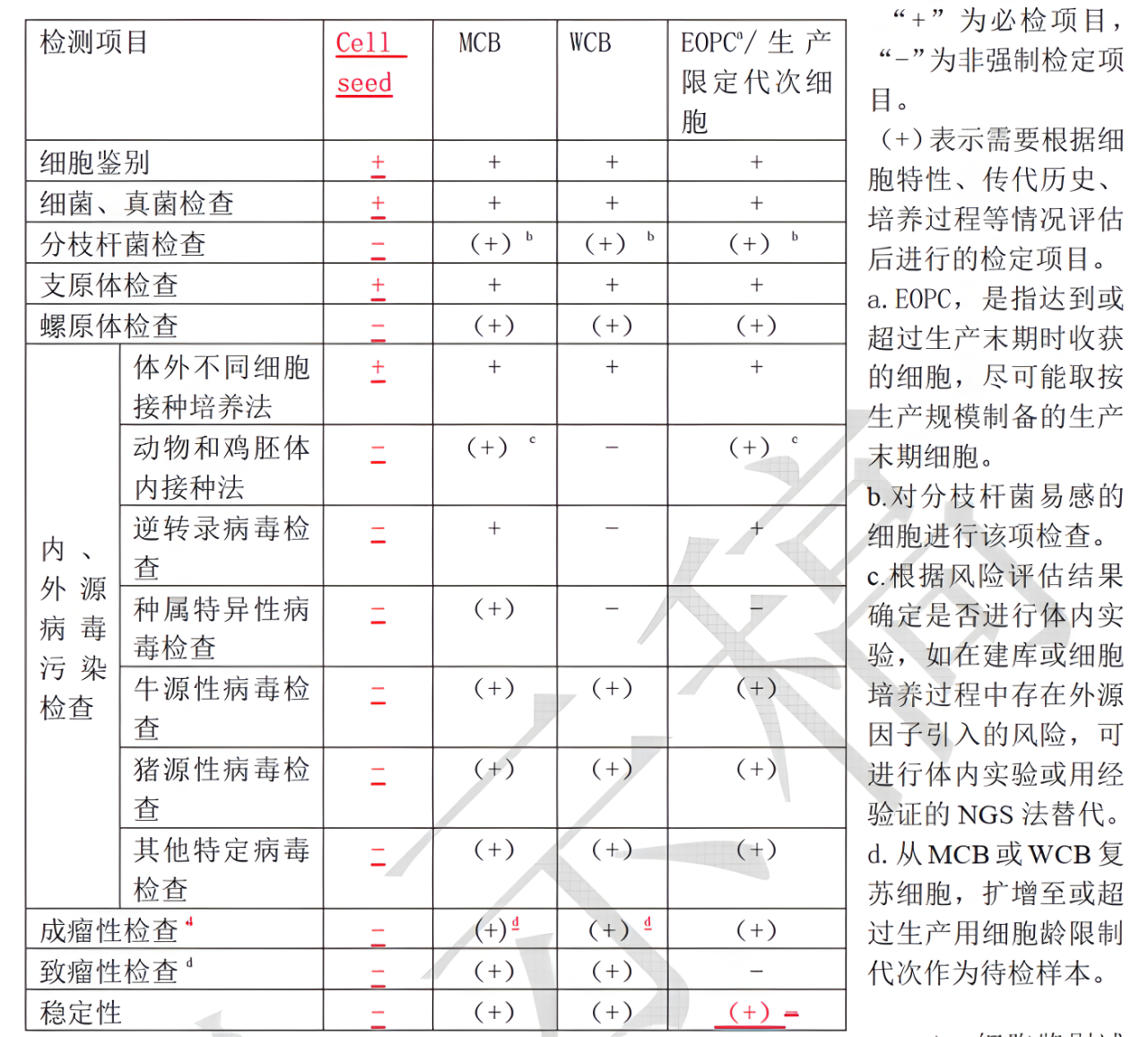
图3:2025新版药典对于细胞库检定项目的推荐
图源:国家药典委员会官网
—— 4.根据新增细胞库类型及方法对于质控要求进行内容新增与调整
为应对新增的昆虫杆状病毒表达系统应用于AAV与蛋白疫苗产品,新增昆虫细胞检定内容;
为应对目前多种类的细胞类型鉴别,新增3430通则规定细胞种属鉴别方法;
为控制病毒安全检测中的动物体内实验的质量,新增3601通则规定检定用动物质量控制对此部分的动物提出要求;
为应对病毒类产品的外源病毒检定要求,调整3302通则外源病毒因子检查的要求;
将检定用细胞检定要求调整形成单独章节;
根据逻辑适用性,在检测内容上新增稳定性与调整染色体检查等内容;
将连续传代细胞系要求与重组细胞的特殊要求融入总体要求。

图4:通则3430、3601、3302与检定用细胞库检定
图源:国家药典委员会官网
总而言之,2025版《中国药典》细胞库制备与质控要求在逻辑上更加清晰,更加符合生产工艺与开发工艺的全流程要求,同时还涵盖了不同申报产品类型的共性要求,这将进一步完善国家标准的科学性、严谨性和适用性,加速推进中国在生物制品研究领域的新质发展!