东方卫视丨微谱科技集团总裁贾梦虹:当好“数智合伙人”,赋能生物医药等产业加速升级
2024/08/19


1月8日,中国食品药品企业质量安全促进会医疗器械分会在上海举办了【国际医疗器械法规公益培训班】,来自长三角地区近百余家医疗器械企业的管理者,注册、研发、技术、市场等相关学员纷纷到场学习,为疫情下医疗器械的未来发展动向给出了答案。

汪衡 /医疗器械安全性评价研究团队化学组负责人
以《满足国内外审评要求的可沥滤物研究方案设计与案例》为主题,与业内专家一起,对美国、欧盟等国家的医疗器械注册法规及流程、医疗器械生物相容性要求及产品检测、临床试验设计要求、临床试验的操作难点等多方面进行了现场解说,帮助中国医疗器械企业了解国内及其它主要国家和地区的医疗器械法规。

利用医疗器械化学表征数据支持医疗器械的生物评价
安全,始于原材料,控制于过程,评价于最终产品。
如何选择合适的原材料?如何评价医疗器械最终产品的安全性?如何确保提交的安全性评价资料符合审评要求?
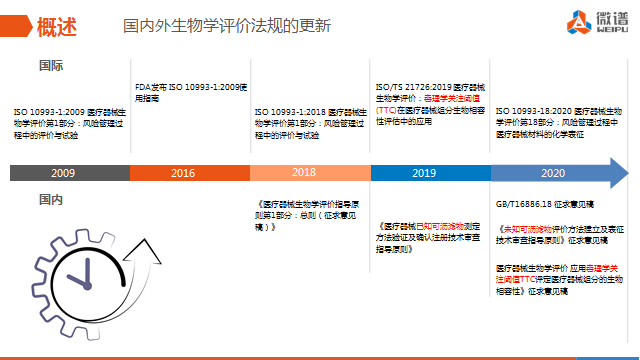
汪衡细数了国内外生物学评价法规更新的路程,尤其是2020年正式发布ISO 10993-18: 2020医疗器械生物学评价第18部分——《风险管理过程中医疗器械材料的化学表征》的核心要点,主要包含化学表征的定义、作用和研究流程。
重新定义化学表征
新评价方法重新定义了化学表征——获取化学信息的过程,通过信息收集或信息生成的方式完成,如文献查阅或化学测试。
而医疗器械的化学表征一般包括确定产品组分成分研究(如产品结构、成分、理化特性等)、浸提研究(extractable study)、可沥滤物研究(leachable study)等。
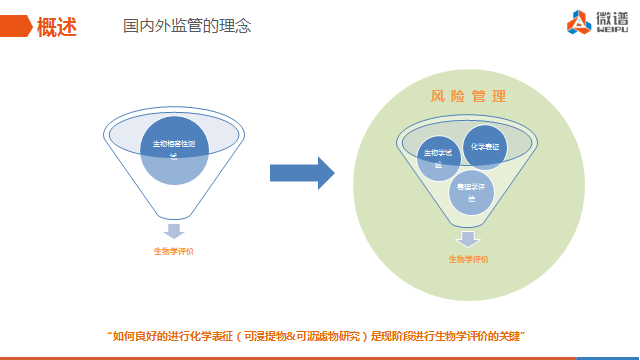
随后,汪衡又从可浸提物和可沥滤物研究要点,如可浸提物和可沥滤物的定义、研究流程和毒理学评估等方面进行来分享。

最后,汪衡先生对可浸提物与可沥滤物研究进行了总结。
01. 已知可沥滤物研究
适用于国内申报注册、低风险产品、常见材料(典型案例DEHP、MDI、环己酮、BPA等)。
特点:相对简单、周期短(1个月)、成本低
02. 未知可沥滤物研究
适用于国内外申报注册、中低风险产品、常见材料(典型案例间接接触、短期血液接触医疗器械)
特点:两组及以上平行样、难度高、周期长(3个月)、成本高、可替代生物相容性实验
03. 可浸提物研究
适用于国内外申报注册、高风险产品、新材料(典型案例长期接触、持久接触医疗器械)
特点:三组平行样、难度高、周期长(3个月)、成本高、可替代生物相容性实验